Научная статья
УДК: 006.617-089СОВРЕМЕННЫЕ МЕТОДЫ ЛЕЧЕНИЯ АНАЛЬНЫХ СТЕНОЗОВ.
М.Ю. Черепенин1, И. В. Лутков1, В.А. Горский2
1ООО «Медицинский центр Елены Малышевой», г. Москва, Россия
2ФГБОУ ВО «Российский национальный исследовательский медицинский университет
им. Н.И. Пирогова МЗ РФ г. Москва Россия
Оригинальная статья
Черепенин Михаил Юрьевич, к.м.н, https://orcid.org/0000-0003-4870-9775, главный врач Медицинского центра Елены Малышевой, 105082, Москва, Россия, тел. +7 (926) 384-04-04 e-mail: md_mike@mail.ru.
Лутков Иван Викторович, к.м.н., https://orcid.org/0000-0001-5348-0464, врач-колопроктолог Медицинского центра Елены Малышевой, 105082, Москва, Россия, тел. +7 (916) 320-12-20 e-mail: lutkov@bk.ru.
Горский Виктор Александрович – д.м.н., профессор кафедры экспериментальной и клинической хирургии медико-биологического факультета ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» МЗ РФ, https://orcid.org/0000-0002-3919-8435, 117997, г. Москва, Россия, тел. +7 (903) 218-81-81 e-mail: gorviks@yandex.ru.
Лутков Иван Викторович, к.м.н., https://orcid.org/0000-0001-5348-0464, врач-колопроктолог Медицинского центра Елены Малышевой, 105082, Москва, Россия, тел. +7 (916) 320-12-20 e-mail: lutkov@bk.ru.
Горский Виктор Александрович – д.м.н., профессор кафедры экспериментальной и клинической хирургии медико-биологического факультета ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» МЗ РФ, https://orcid.org/0000-0002-3919-8435, 117997, г. Москва, Россия, тел. +7 (903) 218-81-81 e-mail: gorviks@yandex.ru.
Содержание:
Резюме
Цель. Разработать и внедрить в практику новую комбинированную методику хирургического лечения анального стеноза, основанную на лазерной деструкции рубцовых тканей диодным лазером. Провести оценку эффективности методики, основываясь на анализе ближайших и отдаленных результатов, наличию послеоперационных осложнений, особенностям технического выполнения, особенностям качества жизни пациентов.
Материалы и методы. В исследовании приняли участие 68 пациентов с анальной стриктурой после хирургического лечения анального канала и (или) прямой кишки. Всем пациентам выполнялась лазерная деструкция послеоперационной рубцовой ткани. По показаниям вводились ботулинический токсин во внутренний сфинктер и (или) PRP-аутоплазма параректально. Хирургическое лечение выполнялось под внутривенным обезболиванием с добавлением тумесцентной анестезии или под местной анестезией раствором артикаина. Применялось лазерное излучение диодного аппарата «Медиола» (производство ЗАО «ФОТЭК», Минск, ФСЗ 2011/0996) с длиной волны 1,56 мкм на мощности 10 Вт.
Результаты. Лазерная коррекция анального стеноза не имеет ограничений по виду и сложности анального стеноза, обладает технической простотой в применении, позволяет минимизировать риск послеоперационного осложнения и рецидива заболевания, обладает высокой эффективностью результата лечения.
Выводы. Методика характеризуется универсальностью и простотой применения, высокой эффективностью результата, высоким качеством жизни пациентов, может применяться рутинно в амбулаторных условиях.
Ключевые слова: анальный стеноз, анальная стриктура, лазер, ботулинический токсин, PRP-аутоплазма.
Конфликт интересов отсутствует.
Материалы и методы. В исследовании приняли участие 68 пациентов с анальной стриктурой после хирургического лечения анального канала и (или) прямой кишки. Всем пациентам выполнялась лазерная деструкция послеоперационной рубцовой ткани. По показаниям вводились ботулинический токсин во внутренний сфинктер и (или) PRP-аутоплазма параректально. Хирургическое лечение выполнялось под внутривенным обезболиванием с добавлением тумесцентной анестезии или под местной анестезией раствором артикаина. Применялось лазерное излучение диодного аппарата «Медиола» (производство ЗАО «ФОТЭК», Минск, ФСЗ 2011/0996) с длиной волны 1,56 мкм на мощности 10 Вт.
Результаты. Лазерная коррекция анального стеноза не имеет ограничений по виду и сложности анального стеноза, обладает технической простотой в применении, позволяет минимизировать риск послеоперационного осложнения и рецидива заболевания, обладает высокой эффективностью результата лечения.
Выводы. Методика характеризуется универсальностью и простотой применения, высокой эффективностью результата, высоким качеством жизни пациентов, может применяться рутинно в амбулаторных условиях.
Ключевые слова: анальный стеноз, анальная стриктура, лазер, ботулинический токсин, PRP-аутоплазма.
Конфликт интересов отсутствует.
Введение
Анальный стеноз продолжает оставаться актуальной проблемой в современной колопроктологии. Приобретенные анальные стенозы часто называют стриктурой, и они в 90% случаев развиваются после проведенного хирургического вмешательства на анальном канале [1]. Частота встречаемости по разным данным составляет от 1,5 до 9% среди всех прооперированных пациентов с доброкачественными заболеваниями прямой кишки и анального канала [2].
Предрасполагающими факторами развития стеноза анального канала являются аутоиммунные заболевания, патология желудочно-кишечного тракта, наличие пищевой или медикаментозной аллергии, спаечные процессы в брюшной полости и малом тазу, быстрый тип ацетилирования, нарастание числа положительных реакций тест-системы с антигенным рубцовым комплексом и сывороток крови больных в динамике. Эти факторы обуславливают усиление формирования плотной рубцовой ткани в избыточном количестве у пациентов после оперативного вмешательства на анальном канале [3].
Основная причина стриктур анального канала – это избыточный объем хирургического вмешательства. Также частой причиной является развитие гнойно-септических осложнений в послеоперационном периоде [4].
Лечение анального стеноза зависит от степени выраженности рубцовых изменений. При легких степенях стеноза рекомендуется проводить консервативное лечение, существуют методики бужирований и дивульсий с применением конусов различных диаметров, пневмодилятаторы и пр. [5]. Стриктуры средней и тяжелой степени нуждаются в хирургическом лечении. В современной медицине существует много описанных методик хирургического лечения анальных стенозов, в большинстве это пластические операции.
Наиболее частым осложнением хирургического лечения является анальная недостаточность (до 39%). Кроме того, встречаются послеоперационные кровотечения, некрозы, нагноения, длительно незаживающие раны (до 18%). Частота рецидивов заболевания достигает 25% [6].
Методики анальных пластик имеют несколько основных вариантов и их модификаций - Y-V анопластика, пластика ромбовидным лоскутом, "house flap" анопластика, островковые лоскуты, анопластика с внутренней сфинктеротомией и пр. [7,8,9,10]. Послеоперационные осложнения обусловлены сложностью процесса заживления анального канала в связи с высоким уровнем смещаемости тканей заднего прохода с их дефекационной травматизацией и постоянным высоким уровнем бактериальной контаминации послеоперационных ран. Кроме того, анальный стеноз всегда подразумевает ослабленную сосудистую микроциркуляцию со снижением уровня оксигенации в рубцовых тканях.
Все виды анопластик и сфинктеротомий для повышения уровня их эффективности в настоящее время применяются выборочно для каждого пациента по индивидуальным показаниям и нередко комбинированно. Но даже при таких условиях уровень осложнений остается на уровне не менее 13%, а уровень рецидивов заболевания – не менее 7% [11,12,13,14,15].
Предрасполагающими факторами развития стеноза анального канала являются аутоиммунные заболевания, патология желудочно-кишечного тракта, наличие пищевой или медикаментозной аллергии, спаечные процессы в брюшной полости и малом тазу, быстрый тип ацетилирования, нарастание числа положительных реакций тест-системы с антигенным рубцовым комплексом и сывороток крови больных в динамике. Эти факторы обуславливают усиление формирования плотной рубцовой ткани в избыточном количестве у пациентов после оперативного вмешательства на анальном канале [3].
Основная причина стриктур анального канала – это избыточный объем хирургического вмешательства. Также частой причиной является развитие гнойно-септических осложнений в послеоперационном периоде [4].
Лечение анального стеноза зависит от степени выраженности рубцовых изменений. При легких степенях стеноза рекомендуется проводить консервативное лечение, существуют методики бужирований и дивульсий с применением конусов различных диаметров, пневмодилятаторы и пр. [5]. Стриктуры средней и тяжелой степени нуждаются в хирургическом лечении. В современной медицине существует много описанных методик хирургического лечения анальных стенозов, в большинстве это пластические операции.
Наиболее частым осложнением хирургического лечения является анальная недостаточность (до 39%). Кроме того, встречаются послеоперационные кровотечения, некрозы, нагноения, длительно незаживающие раны (до 18%). Частота рецидивов заболевания достигает 25% [6].
Методики анальных пластик имеют несколько основных вариантов и их модификаций - Y-V анопластика, пластика ромбовидным лоскутом, "house flap" анопластика, островковые лоскуты, анопластика с внутренней сфинктеротомией и пр. [7,8,9,10]. Послеоперационные осложнения обусловлены сложностью процесса заживления анального канала в связи с высоким уровнем смещаемости тканей заднего прохода с их дефекационной травматизацией и постоянным высоким уровнем бактериальной контаминации послеоперационных ран. Кроме того, анальный стеноз всегда подразумевает ослабленную сосудистую микроциркуляцию со снижением уровня оксигенации в рубцовых тканях.
Все виды анопластик и сфинктеротомий для повышения уровня их эффективности в настоящее время применяются выборочно для каждого пациента по индивидуальным показаниям и нередко комбинированно. Но даже при таких условиях уровень осложнений остается на уровне не менее 13%, а уровень рецидивов заболевания – не менее 7% [11,12,13,14,15].
Цели исследования. Разработать и внедрить в практику новую комбинированную методику хирургического лечения анального стеноза, основанную на лазерной вапоризации и деструкции тканей диодным лазером. Провести оценку эффективности методики, основываясь на анализе ближайших и отдаленных результатов, наличию послеоперационных осложнений, особенностям технического выполнения, особенностям качества жизни пациентов.
Материалы и методы
В исследование были включены 68 пациентов с анальной стриктурой, прооперированных за период 2018-2023гг. Критериями исключения были тяжелое соматическое состояние пациентов, недавно перенесенное ОНМК или ОИМ (менее 3 месяцев назад), декомпенсированная форма сахарного диабета, почечная или печеночная недостаточность. Пациенты были условно распределены на 3 группы по степени сужения — слабая, средняя, тяжелая. Степени прямо коррелировали с величиной рубцовых изменений, объемом хирургического лечения и сложностями послеоперационной реабилитации (таб.1).
В исследование были включены 68 пациентов с анальной стриктурой, прооперированных за период 2018-2023гг. Критериями исключения были тяжелое соматическое состояние пациентов, недавно перенесенное ОНМК или ОИМ (менее 3 месяцев назад), декомпенсированная форма сахарного диабета, почечная или печеночная недостаточность. Пациенты были условно распределены на 3 группы по степени сужения — слабая, средняя, тяжелая. Степени прямо коррелировали с величиной рубцовых изменений, объемом хирургического лечения и сложностями послеоперационной реабилитации (таб.1).

Всем исследуемым пациентам выполнялась лазерная деструкция рубцовой ткани анального канала и (или) нижнеампулярного отдела прямой кишки. Объемные келлоидные рубцы подвергались внутритканевой деструкции, поверхностная рубцовая ткань обрабатывалась точечно внешним бесконтактным воздействием. Мощность излучения во всех случаях была 10 Вт, режим импульсный 0,5/0,5 сек. Длительность экспозиции при проведении процедуры составляет не более 1 секунды в одной точке при внутритканевом воздействии и около 0,5 сек при поверхностной обработке менее плотных тканей. Расстояние между соседними точками воздействия составляло в среднем около 1-2 мм. Воздействие проводилось под визуальным контролем световой пилотной метки, также визуально дополнительно оценивалась интенсивность воздействия по изменению цвета рубцовой ткани с белого на желто-серый. Появление более темных оттенков говорит о начале карбонизации тканей, что создает условия для развития послеоперационных осложнений. При наличии анальной трещины в рубцовых тканях воздействие было аналогичным. У первых 12 прооперированных пациентов выполнялась аноректальная манометрия (сфинктерометрия) через 3-4 месяца после операции для оценки функционального состояния запирательного аппарата. У остальных 56 пациентов исследование не выполнялось на основании полученных положительных данных у обследованных 12 пациентов и на основании отсутствия функциональных жалоб среди всех прооперированных пациентов. У 43 из этих 56 пациентов было наличие анальной трещины в рубцовых тканях и выраженный болевой синдром. С целью профилактики послеоперационного спазма и с целью улучшения сосудистого питания тканей этим 43 пациентам интраоперационно вводился ботулинический токсин в дозе 50 МЕ во внутренний сфинктер. У 7 пациентов было отмечено длительное заживление послеоперационных ран более 2 месяцев, с целью коррекции вводилась PRP-аутоплазма параректально, положительный результат заживления был зафиксирован во всех случаях (таб.2).
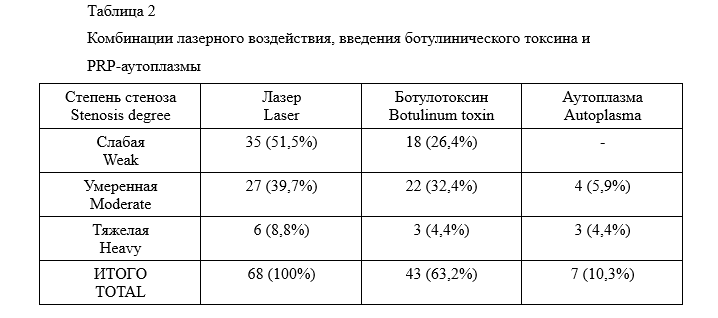
Большинство хирургических вмешательств (65 человек) проводилось под внутривенной анестезией с добавлением тумесцентной анестезии. В 3 случаях по желанию пациентов вмешательства были выполнены под местной инфильтрационной анестезией раствором артикаина. Все пациенты после операции госпитализировались в дневной стационар. Контрольные осмотры проводились через 2 недели, 1, 3 и 12 месяцев.
Оценка результатов проводилась по выраженности и длительности послеоперационного болевого синдрома, срокам регенерации ран, наличию послеоперационных осложнений и рецидива заболевания, по удовлетворенности пациента проведенным лечением.
Оценка результатов проводилась по выраженности и длительности послеоперационного болевого синдрома, срокам регенерации ран, наличию послеоперационных осложнений и рецидива заболевания, по удовлетворенности пациента проведенным лечением.
Результаты и их обсуждение
Результаты лечения оценивались через 1, 3 и 12 месяцев. В эти сроки были прослежены результаты у всех 68 пациентов (100%).
Оценка болевого синдрома проводилась по шкале ВАШ. Всем пациентам интраоперационно вводился кеторолак 30 мг однократно. Необходимости проведения дополнительного обезболивания не потребовалось ни в одном случае. Продолжительность госпитализации для всех пациентов составила до 5 часов. В послеоперационном периоде назначались НПВС класса селективных ингибиторов ЦОГ (таб.3).
Оценка болевого синдрома проводилась по шкале ВАШ. Всем пациентам интраоперационно вводился кеторолак 30 мг однократно. Необходимости проведения дополнительного обезболивания не потребовалось ни в одном случае. Продолжительность госпитализации для всех пациентов составила до 5 часов. В послеоперационном периоде назначались НПВС класса селективных ингибиторов ЦОГ (таб.3).
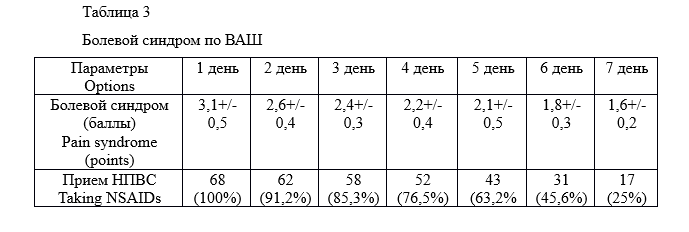
Болевой синдром был не выраженным во всех случаях, зависел от стула и вне стула пациенты обычно не нуждались в дополнительном обезболивании. Через 1 неделю после операции подавляющее большинство пациентов не принимали обезболивающие препараты. Однако, по нашим наблюдениям явления небольшого дискомфорта после стула сохранялись у всех пациентов не менее 1,5 месяцев после хирургического лечения. Длительность сохранения постдефекационных дискомфортных ощущений в отдельных случаях наблюдалась до 6 месяцев без признаков объективных патологических изменений со стороны анального канала. Они имели низкую интенсивность и не требовали дополнительного обезболивания.
Осложнения в ближайшем послеоперационном периоде, такие как нагноение, сфинктероспазм и острая задержки мочи нами не наблюдалось в одном случае. Кровотечение было зафиксировано в одном случае. Оно было выявлено через 1 неделю после проведенного хирургического лечения и выражалось в ежедневном выделении у пациента 20-30 мл крови при дефекации. Дефекация была затруднена в связи с транзиторной слабостью мышечного аппарата, выделение крови происходило из дефектов анодермы, было ликвидировано прошиванием анодермы двумя отдельными швами под местной анестезией.
В начале нашей работы мы наблюдали транзиторную анальную недостаточность слабой степени выраженности в виде периодического плохого удержания газов и ночных скудных выделений кишечной слизи в течение около месяца после операции. В связи с этим фактом у первых 12 пациентов нами проводилась сфинктерометрия (аноректальная манометрия) для оценки функции запирательного аппарата и определения дальнейшей тактики ведения пациентов. Сфинктерометрия выполнялась в сроки через 2-3 месяца после операции и зависела от сроков заживления послеоперационных ран и наличия болевого синдрома. Однако, к концу второго месяца после операции у всех пациентов исчезали субъективные жалобы на нарушение герметичности со стороны заднего прохода. Проведенные исследования показали отсутствие явлений анальной недостаточности (таб.4).
Осложнения в ближайшем послеоперационном периоде, такие как нагноение, сфинктероспазм и острая задержки мочи нами не наблюдалось в одном случае. Кровотечение было зафиксировано в одном случае. Оно было выявлено через 1 неделю после проведенного хирургического лечения и выражалось в ежедневном выделении у пациента 20-30 мл крови при дефекации. Дефекация была затруднена в связи с транзиторной слабостью мышечного аппарата, выделение крови происходило из дефектов анодермы, было ликвидировано прошиванием анодермы двумя отдельными швами под местной анестезией.
В начале нашей работы мы наблюдали транзиторную анальную недостаточность слабой степени выраженности в виде периодического плохого удержания газов и ночных скудных выделений кишечной слизи в течение около месяца после операции. В связи с этим фактом у первых 12 пациентов нами проводилась сфинктерометрия (аноректальная манометрия) для оценки функции запирательного аппарата и определения дальнейшей тактики ведения пациентов. Сфинктерометрия выполнялась в сроки через 2-3 месяца после операции и зависела от сроков заживления послеоперационных ран и наличия болевого синдрома. Однако, к концу второго месяца после операции у всех пациентов исчезали субъективные жалобы на нарушение герметичности со стороны заднего прохода. Проведенные исследования показали отсутствие явлений анальной недостаточности (таб.4).

Сроки заживления послеоперационных ран колебались в пределах от 6 до 20 недель. Они прямо коррелировали с выраженностью рубцовых изменений (таб.5).
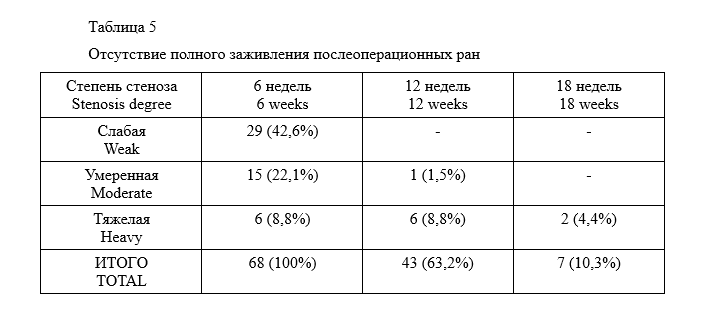
Случаи отсутствия полной эпителизации ран в сроки более 12 недель были отнесены нами в разряд осложнений – длительно незаживающие раны.
Всем пациентам проводилась оценка функции держания через 1 год по шкале Векснера. Во всех случаях нарушений выявлено не было (0 балов). Всем пациентам с профилактической целью в послеоперационном периоде после стихания болевых и дискомфортных ощущений рекомендовалась гимнастика Кегеля не менее 2 раз в день на срок не менее 3 месяцев.
В отдаленном послеоперационном периоде кроме функции запирательного аппарата нами оценивалось наличие длительно незаживающих ран и рецидивов заболевания через 3 и 12 месяцев после операции. Через 3 месяца эпителизация не была достигнута у 7 пациентов (10,3%), периодические явления дискомфорта отмечали 18 пациентов (26,5%). Через 12 месяцев дефектов заживления и явления значимого для пациента дискомфорта не было ни в одном случае.
Все пациенты с длительно незаживающими ранами были из группы тяжелых стенозов. Во всех случаях мы выполняли повторную лазерную обработку торцевым световодом раневого дефекта под местной анестезией сочетая ее с параректальным введением аутоплазмы и применением коллагеновых повязок местно. В сроки до 2 месяцев после проведенных манипуляций раны эпителизировались во всех случаях.
Оценка качества жизни проводилась нами через 1 и 12 месяцев после проведенного лечения. Во всех случаях пациенты отмечали значительное улучшение качества жизни на вторые сутки послеоперационного периода и характеризовали результаты ка хорошие
Всем пациентам проводилась оценка функции держания через 1 год по шкале Векснера. Во всех случаях нарушений выявлено не было (0 балов). Всем пациентам с профилактической целью в послеоперационном периоде после стихания болевых и дискомфортных ощущений рекомендовалась гимнастика Кегеля не менее 2 раз в день на срок не менее 3 месяцев.
В отдаленном послеоперационном периоде кроме функции запирательного аппарата нами оценивалось наличие длительно незаживающих ран и рецидивов заболевания через 3 и 12 месяцев после операции. Через 3 месяца эпителизация не была достигнута у 7 пациентов (10,3%), периодические явления дискомфорта отмечали 18 пациентов (26,5%). Через 12 месяцев дефектов заживления и явления значимого для пациента дискомфорта не было ни в одном случае.
Все пациенты с длительно незаживающими ранами были из группы тяжелых стенозов. Во всех случаях мы выполняли повторную лазерную обработку торцевым световодом раневого дефекта под местной анестезией сочетая ее с параректальным введением аутоплазмы и применением коллагеновых повязок местно. В сроки до 2 месяцев после проведенных манипуляций раны эпителизировались во всех случаях.
Оценка качества жизни проводилась нами через 1 и 12 месяцев после проведенного лечения. Во всех случаях пациенты отмечали значительное улучшение качества жизни на вторые сутки послеоперационного периода и характеризовали результаты ка хорошие
Обсуждение
Лазерная коррекция анального стеноза имеет небольшой опыт применения. Однако, полученные нами результаты свидетельствуют о ее высокой эффективности и безопасности. Воздействие на рубцовые ткани лазерным излучением на мощности 10 Вт в импульсном режиме позволяет точечно и детально под визуальным контролем ликвидировать рубцовые изменения, а в процессе заживления раневых поверхностей благодаря оптимальному соотношению коллагенов I и III типа формируется не ригидная, а эластичная фиброзная ткань, близкая по своим свойствам к нормальной слизистой оболочке анального канала. Это позволяет в послеоперационном периоде вернуть анальному каналу его эластические свойства.
Сочетание лазерного воздействия с введением ботулинического токсина во внутренний сфинктер обеспечивают ускорение процессов заживления за счет улучшения оксигенации тканей. В случаях массивных рубцовых процессов с явлениями длительного заживления ран процесс регенерации эффективно стимулируется параректальным введение PRP-аутоплазмы. Малоинвазивность методики и возможности комбинированного индивидуального подхода создают условия для минимизации рисков послеоперационных осложнений и обеспечивают выздоровление пациента без вероятности развития рецидива заболевания.
Сочетание лазерного воздействия с введением ботулинического токсина во внутренний сфинктер обеспечивают ускорение процессов заживления за счет улучшения оксигенации тканей. В случаях массивных рубцовых процессов с явлениями длительного заживления ран процесс регенерации эффективно стимулируется параректальным введение PRP-аутоплазмы. Малоинвазивность методики и возможности комбинированного индивидуального подхода создают условия для минимизации рисков послеоперационных осложнений и обеспечивают выздоровление пациента без вероятности развития рецидива заболевания.
Выводы
Разработанная нами методика хирургического лечения анального стеноза на основе лазерного воздействия обладает высокой эффективностью – во всех случаях нами достигнут положительный результат лечения. Она безопасна в применении – из зафиксированных осложнений единичное слабо выраженное кровотечение и около 10% случаев длительно незаживающих ран. Выделение крови не нуждалось в экстренных мероприятиях и не несло рисков для жизни и здоровья пациента. Длительно незаживающие раны эпителизировались во всех случаях за счет повторной лазерной обработки раневых поверхностей с применением параректального введения аутоплазмы и назначением коллагеновых повязок в виде местного лечения. Болевой синдром имел низкую интенсивность и продолжительность в послеоперационном периоде. Все пациенты отметили по результатам лечения значительное улучшение качества жизни и оценили результаты лечения как отличные и хорошие. Техника выполнения методики отличается простотой, удобством и быстротой. Не имеет ограничений по степени и выраженности стеноза. Может выполняться амбулаторно, в том числе под местной анестезией. Лазерная коррекция анальной стриктуры является достойной заменой хирургическим анопластике для решения сложной проблемы анальных стенозов.
Список литературы
- Brisinda G, Vanella S, Cadeddu F, Marniga G, Mazzeo P, Brandara F, Maria G. Surgical treatment of anal stenosis. World J Gastroenterol 2009; 15:1921-1928.
- Шевчук И. М., Садовый И. Я., Яворский М. И. Клиническая и лучевая диагностика послеоперационных стриктур анального канала. Хирургия. Восточная Европа. 2013;1(05):47-52. / Shevchuk I. M., Sadovyi I. Ya., Yavorsky M. I. Clinical and radiological diagnosis of postoperative strictures of the anal canal. Hirurgiya. Vostochnaya Yevropa. 2013;1(05):47-52.
- Муравьев А.В., Лысенко О.В., Лаврешин П.М., Муравьев К.А., Галстян А.Ш., Оверченко Д.Б. Профилактика анального стеноза. Колопроктология. 2018;(2S):25a-26. / Muravyov A.V., Lysenko O.V., Lavreshin P.M., Muravyov K.A., Galstyan A.Sh., Overchenko D.B. Prevention of anal stenosis. Coloproctologiya. 2018;(2S):25a-26.
- Лаврешин П.М, Муравьев А.В, Муравьев К.А, Гобеджишвили В.К, Линченко В., 'Гобеджишвили В.В, Кораблина С.С, Лысенко О.А. Стеноз анального канала – обоснование причин его развития. Колопроктология. 2014;(1S):19-23. / 4. Lavreshin P.M., Muravyov A.V., Muravyov K.A., Gobedzhishvili V.K., Lynchenko V., Gobedzhishvili V.V., Korablina S.S., Lysenko O.A. Anal canal stenosis – substantiation of the reasons for its development. Coloproctologiya. 2014;(1S):19-23.
- Milsom JW, Mazier WP. Classification and management of postsurgical anal stenosis. Surg Gynecol Obstet 1986; 163:60-64.
- Liberman H, Thorson AG. How I do it: anal stenosis. Am J Surg 2000; 179:325-329.
- С.В. Кусьминова, Ан В.К., Е.Е. Ачкасов. Оценка качества жизни больных с послеоперационными стриктурами анального канала при различных видах анопластики. 2011. Лекарство. / S.V. Kusminova, An V.K., E.E. Achkasov. Assessment of the quality of life of patients with postoperative strictures of the anal canal with various types of anoplasty. 2011. Lekarstvo.
- Помазкин В.И., Мансуров Ю.В. Хирургическое лечение рубцовых стриктур анального канала. Хирургия. Журнал им. Н.И. Пирогова. 2011;(1):48‑51. / Pomazkin V.I., Mansurov Yu.V. Surgical treatment of scarring strictures of the anal canal. Surgery. Journal im.N.I. Pirogova. 2011;(1):48 51.
- Caplin DA, Kodner IJ. Repair of anal stricture and mucosal ectropion by simple flap procedures. Dis Colon Rectum 1986; 29:92-94.
- .Jorge A Lagares-Garcia, Juan Nogueras. Anal stenosis and mucosal ectropion. January 2003. Surgical Clinics of North America 82(6):1225-31. DOI: 10.1016/S0039-6109(02)00081-6
- Owen HA, Edwards DP, Khosraviani K, Phillips RK. The house advancement anoplasty for treatment of anal disorders. J R Army Med Corps 2006; 152:87-88.
- .Maria G, Brisinda G, Civello IM. Anoplasty for the treatment of anal stenosis. Am J Surg 1998; 175:158-160
- .Abr-Gama A, Sobrado CW, Araujo SE, Nahas SC, Birbojm I, Nahas CS, et al. Surgical treatment of anal stenosis: assessment of 77 anoplasties. Clinics 2005; 60:17-20.
- .Aitola PT, Hiltunen KM, Matikainen MJ. Y-V anoplasty combined with internal sphincterotomy for stenosis of the anal canal. Eur J Surg 1997; 163:839-842
- Omar Mohamed Mokbel. Anoplasty for anal stenosis after hemorrhoidectomy: rhomboid or V-Y flap technique. World J Surg.2018 Sep;42(9):3015-3020. doi: 10.1007/s00268-018-4561-6